采用了旭化成彩色纤维素微粒"NanoAct®"的COVID-19抗原快诊产品美国上市销售
采用了旭化成株式会社(总部:东京都千代田区、总经理:小堀秀毅、以下简称"本公司")彩色纤维素微粒"NanoAct®"的Access Bio公司的COVID-19抗原免疫快诊检测试剂盒"CareStart™ COVID-19 Antigen"(以下简称"CareStart™ COVID-19 Ag"),获得了美国食品药品监督管理局(Food and Drug Administration、以下简称"FDA")的紧急使用权(Emergency Use Authorization、以下简称"EUA"),日前在美国开始上市销售。
 "NanoAct®"产品照片
"NanoAct®"产品照片 "CareStart™ COVID-19 Ag"的产品照片
"CareStart™ COVID-19 Ag"的产品照片
1. "NanoAct®"简介
"NanoAct®"是彩色纤维素微粒,使用了本公司核心技术——纤维素加工技术的产品。它主要作为快诊试剂盒的标识颗粒被使用,用于流感及其他传染病等检测试剂盒等。由于多种颜色及阳性检测线的优良显色性能,Access Bio公司非常认可其优良的判读性能,并将其用于"CareStart™ COVID-19 Ag"快诊检测产品。
2. COVID-19抗原快诊检测试剂盒"CareStart™ COVID-19 Ag"简介
随着近期新冠疫情的扩散,短时间内实施筛查的重要性不断增加。其中,不同于PCR检测,不需要特别检测设备的快诊试剂盒※1的需求高涨。在如今全球的诊断药制造商都在研发新冠抗原快诊试剂盒时,行业内疟疾快诊试剂盒的全球最大制造商Access Bio公司(总部:美国新泽西州、总经理:Young H. Choi)率先研发出了"CareStart™ COVID-19 Ag"。
"CareStart™ COVID-19 Ag"在用于临床标本实验中,与RT-PCR※2的阳性一致率达到88.37%(38/43)、阴性一致率达到100%(63/63),因其一致的敏感度,获得了FDA的EUA。另外,普通的PCR检测时间需要1-2天,而本产品的检测时间约为10分钟,这让短时间内完成检测成为可能。同时,"NanoAct®"因其丰富的显色变化这一特点,阳性检测线(图中的"T")为蓝色,质控线※3(图中的"C")为红色,用不同的颜色显示,更易于判断结果,更人性化。
"CareStart™ COVID-19 Ag"除了获得FDA的EUA外,还取得了欧洲的CE注册※4,今后在欧洲、东南亚及非洲各国也将依次开始销售。
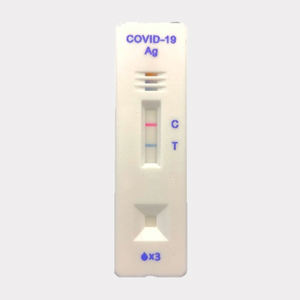 图:阳性检测结果
图:阳性检测结果
3. 展望
美国、欧洲及亚洲各国的诊断药制造商也在进行复合型免疫快诊试剂盒的研发,这是应用"NanoAct®"能同时进行COVID-19抗原检测和流感的三联检测试剂盒,以及其他多种传染病的检测试剂盒,预计今后"NanoAct®"也将被多种试剂盒应用。
今后本公司也将通过自身技术继续为COVID-19的防控做出贡献。
- ※1免疫快诊试剂盒使用抗原与抗体反应的快速胶体金诊断试剂盒
- ※2RT-PCR随时间测量聚合酶链式反应(PCR)的扩增,基于扩增率测量模板DNA定量的方法。
- ※3质控线确认检测是否正常结束的线(当这条线出现时,表明检测正常结束)
- ※4CE注册符合欧盟(EU)标准的标准合格标志
- ※"NanoAct®"是旭化成株式会社的注册商标。
- ※"CareStart™ COVID-19 Ag"是日本国内未批准的体外诊断药医用品。
旭化成株式会社
2020年12月8日
